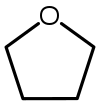
四氢呋喃
| 四氢呋喃 | |||
|---|---|---|---|
|
|||

|
|||
|
IUPAC名 oxolane |
|||
|
系统名 1,4-epoxybutane 1,4-环氧丁烷 oxacyclopentane 氧杂环戊烷 |
|||
| 别名 | THF 丁撑氧 氧化环四亚甲基 呋喃烷 氧化四亚甲 |
||
| 识别 | |||
| CAS号 |
109-99-9 |
||
| PubChem | 8028 | ||
| ChemSpider | 7737 | ||
| SMILES |
|
||
| InChI |
|
||
| InChIKey | WYURNTSHIVDZCO-UHFFFAOYAI | ||
| RTECS | LU5950000 | ||
| 性质 | |||
| 化学式 | C4H8O | ||
| 摩尔质量 | 72.11 g·mol−1 | ||
| 外观 | 透明无色液体 | ||
| 密度 | 0.8892 g/cm3 @ 20 °C, liquid | ||
| 熔点 | −108.4 °C(165 K) | ||
| 沸点 | 66 °C(339 K) | ||
| 溶解性(水) | 无限混溶 | ||
| 黏度 | 0.48 cP at 25 °C | ||
| 结构 | |||
| 分子构型 | 包晶 | ||
| 偶极矩 | 1.63 D (gas) | ||
| 危险性 | |||
欧盟危险性符号 易燃 F 易燃 F
 刺激性 Xi 刺激性 Xi
|
|||
| 警示术语 | R:R11, R19, R36/37 | ||
| 安全术语 | S:S16, S29, S33 | ||
| NFPA 704 |
 3
2
1
|
||
| 闪点 | −14 °C(7 °F;259 K) | ||
| 相关物质 | |||
| 相关杂环 |
呋喃 吡啶 二恶烷 |
||
| 相关化学品 | 乙醚 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
四氢呋喃(THF)是一种环状醚,在常温常压下为粘稠度较小、可与水混溶的无色液体,其化学式可写作。由于液态范围很长,它是一种常用的中等极性非质子性溶剂。它的主要用途是作高分子聚合物的前体。
生产
四氢呋喃每年的产量大约是二十万吨。[1]被应用得最广的制备方法是1,4-丁二醇在酸催化条件下脱水,这类似于通过对乙醇脱水来制备乙烯。而丁二醇可以通过对乙炔羰基化之后加氢得到。杜邦公司发展出一种通过氧化正丁烷来粗制顺酐,再进行催化氢化的生产方式。[2]也可以先对烯丙醇施以氢甲醯化反应,再将产品氢化来生产丁二醇。
THF也可以通过催化氢化呋喃来制备。[3][4]而呋喃可以来自于戊糖。不过这种方法的应用并不广泛。
应用
THF可以在强酸性环境中聚合成链状的聚四氢呋喃 (PTMEG), CAS号 [25190-06-1],也可简写作 PTMO,义为「聚环丁烷氧化物」(polytetramethylene oxide)。它的基本用途是用来制造弹性聚氨酯纤维,比如氨纶。[5]
溶剂
THF的另一个主要用途是在PVC和漆的生产中作工业溶剂。[6]它的介电系数为7.6,是一种非质子溶剂,可以溶解很多极性或者非极性物质。[7] THF可与水混溶,并在低温下形成包合物。[8]
实验室
THF常作为实验室中沸点较高的醚性溶剂。它的氧原子可以与路易斯酸发生配位作用,包括Li+、 Mg2+等,并可以与硼氢化合物形成加合物。因此,THF和乙醚一样,不仅可以在硼氢化反应中作伯醇的溶剂,也可以做比如有机锂化合物和格氏试剂的溶剂。[9]尽管性质与用途与乙醚相似,但THF的性能往往更好,[10]因此,乙醚是很多无水但要求不太苛刻的反应的优良溶剂(比如Grignard试剂参加的反应),而在更大温度范围内,THF是一个更可靠的配体,并在很多精细的化学反应中起到对混合溶剂性质(比如混合溶剂的电学性质)进行微调的作用。
THF被广泛应用在对聚合物的生产研究中。由于它超强的溶解能力,PVC等高聚物都能轻松溶解。
2-甲基四氢呋喃
2-甲基四氢呋喃(2Me-THF)是THF的一种对环境污染更小的同系物,[11]然而其价格更加昂贵。 2Me-THF 的溶剂性能介于乙醚和THF,与水的互溶能力也有限,并与水形成共沸物。2Me-THF相比于THF的另一个优点是它的熔点更低而沸点更高。
安全
THF通常被认为是毒性较小的溶剂。其半数致死量 (LD50)与丙酮接近。因其优良的溶解性能,THF可以渗入皮肤造成失水。THF可以溶解乳胶,因此使用时通常戴丁腈橡胶或氯丁橡胶制的手套。其高度可燃的性质也是安全隐患之一。此外,不同于传闻,不像是呋喃,THF的生殖毒性并不显著,目前没有实验表明低剂量的THF接触能明显使人失去生殖能力。
THF最大的安全隐患在于露置于空气中时会缓慢形成高爆炸性的有机过氧化物。为了减小这个隐患,市售的THF中通常有加入2,6-二叔丁基对甲酚(BHT)来抑制有机过氧化物的产生。同时,THF不应当被蒸干,因为有机过氧化物会被富集在蒸馏残渣中。
参见
引用
- ^ Ethers, by Lawrence Karas and W. J. Piel. Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. 2004.
- ^ Merck Index of Chemicals and Drugs, 9th ed.
- ^ Morrison, Robert Thornton; Boyd, Robert Neilson: Organic Chemistry, 2nd ed., Allyn and Bacon 1972, p. 569
- ^ Donald Starr and R. M. Hixon (1943). "Tetrahydrofuran". Org. Synth.; Coll. Vol. 2: 566.
- ^ Polyethers, Tetrahydrofuran and Oxetane Polymers by Gerfried Pruckmayr, P. Dreyfuss, M. P. Dreyfuss. Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. 1996.
- ^ Herbert Müller, "Tetrahydrofuran" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a26_221
- ^ Chemical Reactivity. Cem.msu.edu. [2010-02-15]. (原始内容存档于2010-03-16).
- ^ FileAve.com (PDF). Gashydrate.fileave.com. [2010-02-15]. (原始内容 (PDF)存档于2011-07-11).
- ^ Elschenbroich, C.; Salzer, A. 」Organometallics : A Concise Introduction」 (2nd Ed) (1992) Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- ^ E.g., B.L. Lucht, D.B. Collum "Lithium Hexamethyldisilazide: A View of Lithium Ion Solvation through a Glass-Bottom Boat" Accounts of Chemical Research, 1999, volume 32, 1035–1042 doi:10.1021/ar960300e
- ^ Greener Solvent Alternatives - Brochure (PDF). [2010-02-15]. (原始内容存档 (PDF)于2011-06-06).
参考
- Loudon, G. Mark. Organic Chemistry 4th ed. New York: Oxford University Press. 2002. pg 318
外部连结
- International Chemical Safety Card 0578(页面存档备份,存于网际网路档案馆)
- NIOSH Pocket Guide to Chemical Hazards(页面存档备份,存于网际网路档案馆)
- THF usage
- THF info
- U.S. OSHA info on THF
- 2-Methyltetrahydrofuran, An alternative to Tetrahydrofuran and Dichloromethane. Sigma-Aldrich. [2007-05-23]. (原始内容存档于2013-07-12).